PASSMED公式LINEの登録者特典|当サイトに掲載している図表の元データ&学習支援AI 薬科GPTをプレゼント♪
コラテジェンとは、2019年3月26日に「慢性動脈閉塞症」を対象疾患として承認された日本初の遺伝子治療用製品です。少数例の臨床試験しかないため、条件・期限(5年間)付きで承認されています。
「条件及び期限付承認」のため、承認期限は5年間と期限付きです(期限切れのため、現在取り下げて回収中)。
その後、2023年5月31日に正式な承認申請が行われましたが、市販後調査において有効性の再現ができなかったため、販売を終了することになりました。しかし、国内第Ⅲ相臨床試験と米国後期第Ⅱ相臨床試験の結果を中心に申請データパッケージを構築し、2024 年末までに新たな製造販売承認の申請を行う予定とのことです。
アンジェス|HGF 遺伝子治療用製品「コラテジェン」の開発販売戦略の変更に関するお知らせ
基本情報
| 製品名 | コラテジェン筋注用4mg |
| 一般名 | ベペルミノゲン ペルプラスミド |
| 製薬会社 | 製造販売:アンジェス(株) |
| 効能・効果 | 標準的な薬物治療の効果が不十分で血行再建術の施行が困難な慢性動脈閉塞症(閉塞性動脈硬化症およびバージャー病)における潰瘍の改善 |
| 用法・用量 | 通常、成人には、投与対象肢の虚血部位に対して1カ所あたり本品0.5mgを8カ所に4週間間隔で2回筋肉内投与する(1回総計4mg)。 なお、臨床症状が残存する場合には、2回目投与の4週後に3回目の投与を行うこともできる |
| 収載時の薬価 | 4mg 1瓶:600,360円 |
これまでの薬剤(低分子・抗体薬)は、
- 体内に元からあるタンパク質
- 病気によって産生されるタンパク質
- 細菌・ウイルス・がん細胞のタンパク質やDNA
等に作用することで治療を行うものが基本でした。
遺伝子治療とは、ある遺伝子(DNA)を患者さんに投与し、その遺伝子が作り出すタンパク質の作用によって病気を治療することを言います。
今回は閉塞性動脈硬化症(重症虚血肢)とコラテジェン筋注(一般名:ベペルミノゲン ペルプラスミド)の作用機序についてご紹介します。
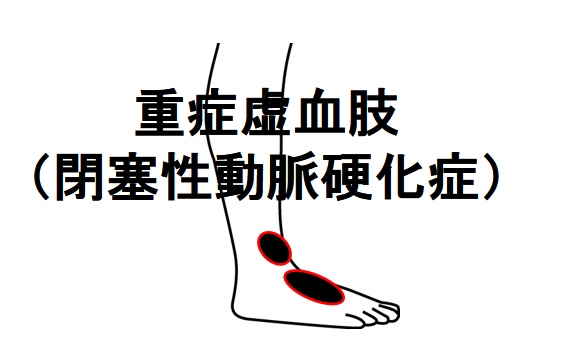
閉塞性動脈硬化症(重症虚血肢)とは
閉塞性動脈硬化症とは、四肢(手や足)の動脈が何らかの原因で閉塞してしまい、手足に血液が供給されなくなってしまう状態を言います。
特に下肢(足)の症状が出やすいのが特徴です。
動脈が閉塞(詰まってしまう)する原因は様々ですが、以下のような生活習慣病をきっかけに動脈硬化が起こり、それによって引き起こされることが多いとされています。
- 高血圧
- 糖尿病
- 脂質異常症(高脂血症)
その他、喫煙によってもそのリスクが高まると言われています。
例えば、脂質異常症ではコレステロールの塊(プラーク)が足の動脈血管内に沈着して血管内が細くなっていることがあります。
ここに血栓などが詰まってしまうと、動脈の血流が止まってしまい、それ以降の組織や細胞に栄養・酸素を届けられなくなってしまいます(虚血状態)。
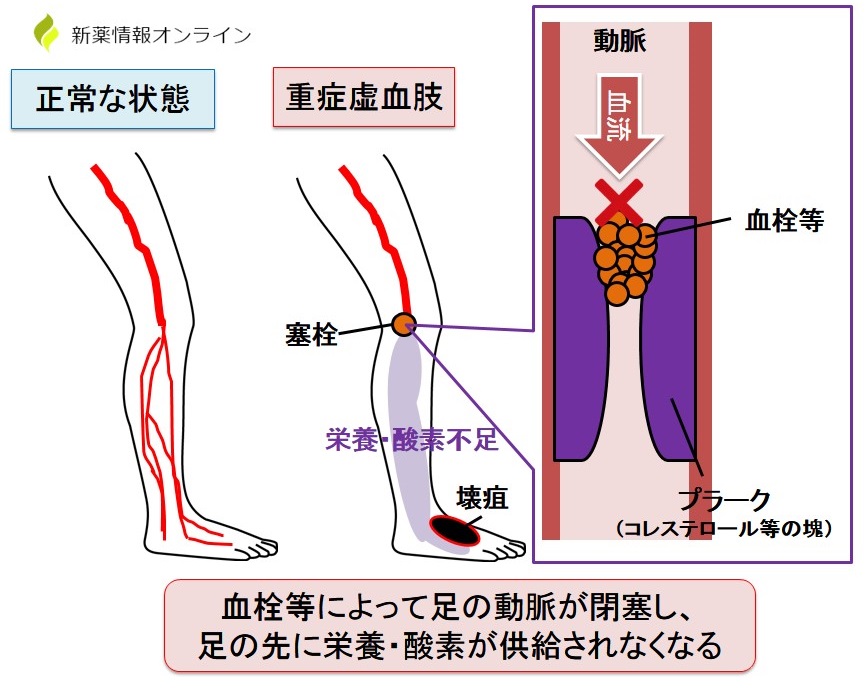
これが重度(重症)の場合、「重症虚血肢」と呼ばれ、組織の壊疽(組織・細胞の腐敗)が起こることもあります。
閉塞性動脈硬化症の重症度と症状
閉塞性動脈硬化症の初期の自覚症状としては、下肢の冷感やしびれ感などがあります。
また、重症度と症状に応じて以下の「Fontaine分類」がよく用いられています。
| Fontaine分類 | 虚血具合 | 症状 |
| Ⅰ度 | 軽度虚血 | 冷感やしびれ感があるが、一過性ですぐに消失することもある。 |
| Ⅱ度 | 中等度虚血 | 歩いた時に足の筋肉に痛みを感じ、歩きにくくなる。 |
| Ⅲ度 | 高度虚血 | 安静時にも足に痛みを感じる。 |
| Ⅳ度 | 重度虚血 | 壊疽や潰瘍が見られる。 |
特にⅢ度とⅣ度は「重症虚血肢」と呼ばれていて、足の切断を余儀なくされる場合もある重篤な疾患です。
閉塞性動脈硬化症の治療
閉塞性動脈硬化症の治療は重症度(Fontaine分類)に応じ、適宜組み合わせて行われます。
- 運動療法や生活改善:Ⅰ~Ⅱ度
- 原因疾患(生活習慣病)の治療:Ⅰ~Ⅱ度
- 抗血小板剤などの薬物療法:Ⅰ~Ⅳ度
- 外科的な血行再建(自家静脈や人工血管によるバイパス術):Ⅲ~Ⅳ度
- バルーンやステントを用いた血管拡張術:Ⅲ~Ⅳ度
重症虚血肢(Ⅲ・Ⅳ度)ではバイパス術や血管拡張術が行われ、閉塞部位を回避することができるため症状の緩和効果も期待できます。
しかし、完全に閉塞してしまっている場合や広範囲に及んでいる場合、全身状態が不良な場合では上記が適さないこともしばしばあります。
その場合、有効な治療選択が無く、足の切断を余儀なくされていました。
今回ご紹介するコラテジェンは重症虚血肢(Ⅲ・Ⅳ度)に対して有望な治療薬です!
コラテジェンは遺伝子治療薬のため、遺伝子とタンパク質合成について簡単に紹介します。
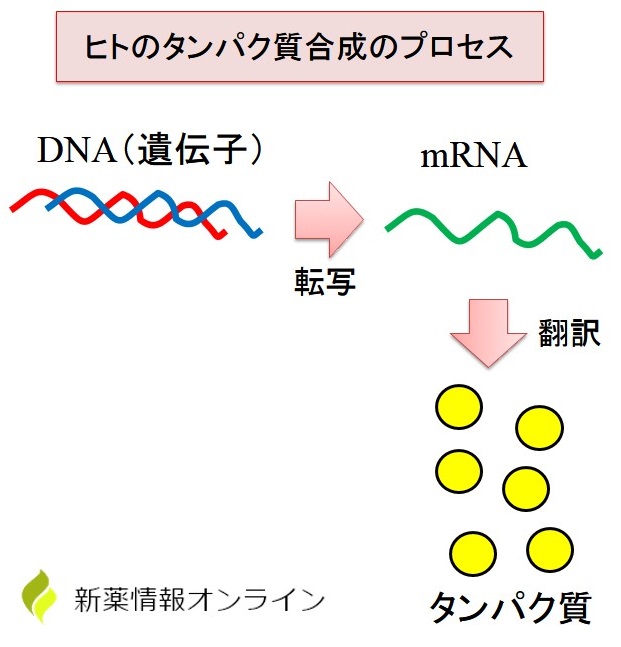
ヒトのタンパク質合成のプロセス
ヒトのタンパク質が合成されるまでには以下のプロセスがあります。
- DNA(遺伝子)の「転写」によってmRNAが合成される。
- mRNAの「翻訳」によってタンパク質が合成される。
コラテジェン(ベペルミノゲン ペルプラスミド)の作用機序
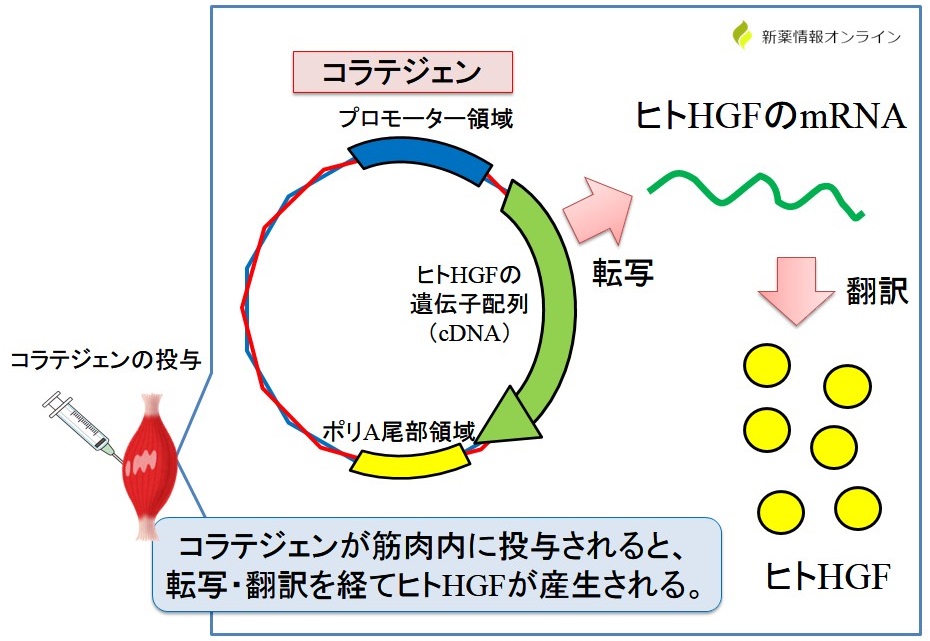
コラテジェンはヒトのHGF遺伝子を組み込んだ「プラスミドDNA構造(環状二本鎖DNA)」を有する製品です!1)
遺伝子治療用プラスミドベクター製品とも言われています。
コラテジェンのHGF遺伝子の前にはプロモーター領域(転写開始)があり、ここから転写が開始されます。
コラテジェンを筋肉内に注射で投与すると、筋肉細胞内で転写が開始され、ヒトHGFのmRNAが合成されます(ポリA尾部領域もあるため、安定化される)。
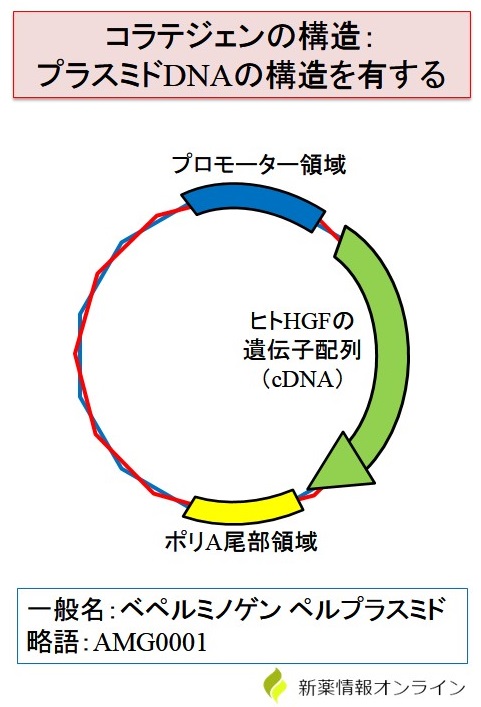
その後、mRNAが翻訳されることでヒトHGFが産生されます。
産生されたHGF(hepatocyte growth factor)は「肝細胞増殖因子」と呼ばれ、様々な臓器の修復や新たな血管を作る作用(血管新生作用)を有しているタンパク質です。
HGFが血管の閉塞箇所付近で作用すると、閉塞箇所を迂回するように新たな血管が作られ(血管新生)、血流が回復します。
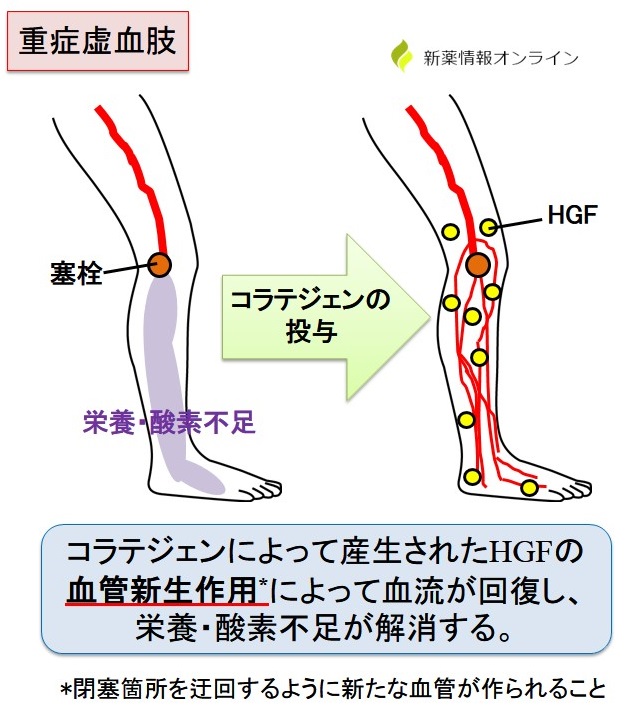
血流が回復する結果、足の末端まで栄養・酸素が届けられるようになり、重症虚血肢の症状緩和効果が得られると考えられます。

エビデンス紹介(国内第Ⅲ相試験)
根拠となった臨床試験を一つご紹介します。
本試験は薬物治療抵抗性で、外科的治療の適用が困難な慢性動脈閉塞症(Fontaine分類Ⅲ~Ⅳ度)の患者さんを対象とした国内第Ⅲ相試験です。2)
対象患者さんをコラテジェン筋肉内投与群とプラセボ筋肉内投与群に分けて有効性・安全性が検討されました。
本試験の主要評価項目は12週時点の「改善率*」でした。
| 試験群 | コラテジェン群 | プラセボ群 |
| 12週時点の改善率*(全体) | 70.4% | 30.8% |
| p=0.014 | ||
| Fontaine分類Ⅲ度の 患者さんの改善率* |
50% | 25% |
| p=0.39 | ||
| Fontaine分類Ⅳ度の 患者さんの改善率* |
100% | 40% |
| p=0.018 | ||
*Fontaine分類Ⅲ度の患者さんでは「痛みの改善」、Ⅳ度の患者さんでは「潰瘍の縮小率」
このようにコラテジェンの投与によって症状の改善効果が認められています。

副作用と重大な副作用・発がん性
主な副作用は、注射部位疫病(4.3%)、大腸ポリープ(2.7%)、末梢性浮腫(2.7%)、四肢痛(2.1%)、C一反応性蛋白増加(2.1%)が報告されています。3)
重大な副作用として、悪性腫瘍(胃腺癌0.5%、結腸癌0.5%、胃癌0.5%、肺癌0.5%、前立腺癌0.5%、食道扁平上皮癌0.5%、子宮平滑筋肉腫0.5%)が報告されていますので、投与後は定期的に観察を行い、異常が認められた場合は適切な処置を行うよう注意が必要です。
この考察として、審査報告書には以下のことが述べられていました。5)
良性又は悪性新生物等の発現率は、プラセボ群より本品群で高かった。
しかしながら、本品との因果関係が否定されなかった症例は7 例のみであること、ASO 第Ⅲ相試験ではプラセボ群に対して本品群では観察期間がより長期(本品群:最長13 年、プラセボ群:12 週)になっていること、さらに本品の投与対象となるのは発癌のリスクが高くなる年齢層の患者であること等を考慮すると、現時点で本品と良性又は悪性新生物等の発現との関連は明確ではないと考える。

また、以下にあるように毒性試験では発がん性は認められていなかったようです。5)
毒性試験結果において発がんリスクに関する懸念は認められておらず、本品が腫瘍を増悪させるとの臨床試験成績は得られていないものの、発現産物であるhHGF は血管新生作用により悪性腫瘍の成長を促進する可能性がある。
そのため、添付文書において、本品の投与部位の近傍(筋肉及び周辺組織)に悪性腫瘍がある患者又はその既往歴のある患者に対する本品の投与は禁忌として設定し、本品の投与部位の近傍以外に悪性腫瘍がある患者に対しては慎重に本品の投与可否を検討する必要がある旨を注意喚起する。
以上より、禁忌として以下が規定され、本当にコラテジェンに発がん性があるのかどうかは今後、長期的に検討されることと思います。
投与部位筋肉及び周辺組織に悪性腫瘍のある患者又はその既往歴のある患者
用法・用量
虚血部位1か所当たり0.5mgを8か所に4週間間隔で2回筋肉内投与します(1回総計4mg)。
なお、臨床症状が残る場合には、2回目投与の4週間後に3回目の投与が可能とのことです。
収載時の薬価
収載時(2019年9月4日)の薬価は以下の通りです。
- 4mg 1瓶:600,360円
薬価算定の根拠は以下の記事をご参考ください。
-

-
【新薬:薬価収載】12製品+再生医療等製品(2019年9月4日)
続きを見る
参考までに、再生医療等製品の保険適用は、医薬品(薬価)か医療機器(材料価格)か、個別に判断されます。
<平成 26 年 11 月5日 中医協総-2-1(抜粋)>
1.保険適用に係る今後の対応について
○ 再生医療等製品の保険適用に関する当面の間の対応
・薬事法改正後に承認(条件・期限付承認を含む。)された再生医療等製品については、保険適用の希望のあった個別の製品の特性を踏まえ、医薬品の例により対応するか、医療機器の例により対応するかを、薬事承認の結果を踏まえて判断
※引用:厚生労働省|中央社会保険医療協議会 総会(第285回) 議事次第>再生医療等製品の保険上の取扱いに関する今後の検討について
コラテジェンは2019年3月27日の中央社会保険医療協議会 総会(第411回)にて医薬品として薬価収載されることが了承されていますね。4)
条件及び期限付承認とは?
今回コラテジェンは「再生医療等製品における条件及び期限付き承認制度」によって承認される見込みです。
これは少数例の臨床試験等で
- 有効性がある程度担保される
- 安全性が確認
されれば、条件及び期限を付して早期に承認されるという制度のことですね。
2018年12月にも再生医療等製品のステミラック注が同制度によって早期承認されています。(7年間の限定付き)
-
-
ステミラック注(骨髄由来間葉系幹細胞)の作用機序・特徴【骨髄損傷】
続きを見る
今回のコラテジェンもこれまでの臨床試験における症例数が少ないことから「条件及び期限付承認」扱いとされ、その期限は5年とされました。
5年以内にコラテジェン群120例と対照群(標準療法)80例を比較評価し、有効性が確認されれば正式承認の流れです。

コラテジェンの承認条件
その他にも以下の承認条件が付加されています。
- 重症化した慢性動脈閉塞症に対する十分な知識や治療経験を持つ医師のもとで、創傷管理を複数診療科で連携して実施している施設で使用する
- 条件・期限付き承認後にあらためて行う製造販売承認申請までの期間中は、全症例を対象として製造販売後承認条件評価を行う

まとめ・あとがき
コラテジェンはこんな薬
- 日本初の再生医療治療薬
- HGF遺伝子によってHGFが産生される
- 血管新生によって重症虚血肢の症状を改善
- 条件・期限付き(5年間)の承認 → 期限切れで承認取り下げ&回収
コラテジェンは国内初の遺伝子治療製品として非常に注目されています!
似たような薬剤として、「アンチセンス核酸医薬品」がありますが、これは標的RNAに結合して、その遺伝子発現を調整する合成ヌクレオチドですので、遺伝子治療とは少し異なりますね。
-

-
スピンラザ(ヌシネルセン)の作用機序【脊髄性筋委縮症】
続きを見る
治療選択肢が少なかった重症虚血肢に対してコラテジェンは新たな選択肢のため、治療成績の改善に寄与できるのではないでしょうか。
今後も様々な疾患に対して遺伝子治療薬の開発が進んでいますので、注目していきたいと思います。
以上、今回は閉塞性動脈硬化症(重症虚血肢)とコラテジェン筋注(一般名:ベペルミノゲン ペルプラスミド)の作用機序についてご紹介しました!
引用文献・資料等
- 第18回厚生科学審議会 再生医療等評価部会「資料1」
- Gene Ther. 2010 Sep;17(9):1152-61.
- コラテジェン 添付文書
- 厚労省:中央社会保険医療協議会 総会(第411回) 議事次第「再生医療等製品の医療保険上の取扱いについて:総-3(PDF:397KB)」
- コラテジェン 審査報告書
\ 新薬情報オンラインの運営者が執筆! /
薬剤師におススメの記事
失敗しない薬剤師の転職とは?
数多く存在する薬剤師専門の転職エージェントサイト。
どこに登録したらいいのか悩むことも少なくありません。そんな転職をご検討の薬剤師さんに是非見ていただきたい記事を公開しました。
- 新薬情報オンラインの薬剤師2名が実際に利用・取材!
- 各サイトの特徴等を一覧表で分かりやすく掲載!
- 絶対にハズレのない厳選の3サイトを解説!
上手に活用してあなたの希望・条件に沿った【失敗しない転職】を実現していただけると嬉しいです!
-

-
薬剤師の転職サイト3選|評判・求人特徴とエージェントの質を比較
続きを見る
日々の情報収集に最適
-

-
薬剤師の勉強・情報収集に役に立つ無料サイト・ブログ8選



































