PASSMED公式LINEの登録者特典|当サイトに掲載している図表の元データ&学習支援AI 薬科GPTをプレゼント♪
「脊髄損傷に伴う神経症候及び機能障害の改善(ただし、ASIA機能障害尺度がA、B、Cの患者に限る)」を効能・効果とするステミラック注(一般的名称:ヒト(自己)骨髄由来間葉系幹細胞)が2018年12月28日に条件及び期限付承認を取得しました!
「条件及び期限付承認」のため、承認期限は7年間と期限付きです。その後、2025年11月14日に新再生医療等製品として本承認申請が実施されました(ニュースリリース)
ステミラックは脊髄損傷の治療として初の間葉系幹細胞を用いた「再生医療等製品」で、これまでにない新規性(世界初!)を有している製品です!
また本剤は2016年に「先駆け審査指定制度」の対象に指定されています。
再生医療等製品版の先駆け審査指定制度では初の承認ですね。
今回は脊髄損傷とステミラック注の作用機序・特徴についてご紹介します。
脊髄損傷とその症状・合併症
脊髄は、脳の延髄から背骨の中に通っている中枢神経です。
ヒトの様々な動きや知覚、自律神経などは全て脊髄の神経によって支配されています。
この脊髄が何らかの原因で損傷を受けてしまうことを「脊髄損傷」と呼んでいます。
日本脊髄障害医学会の1990年~1992年の調査では、脊髄損傷の主な受傷原因の割合は以下の通りでした。
- 交通事故:43.7%
- 高所所からの落下:28.9%
- 転倒:12.9%
- 打撲・下敷き:5.5%
- スポーツ:5.4%
- その他:3.6%
ただし、20年程前のデータのため、現在とは割合が若干変わっている可能性があります。
また脊髄の損傷の具合によって完全損傷と不完全損傷があります。
- 完全損傷:脊髄機能が完全に失われた状態
- 不完全損傷:脊髄機能の一部が失われた状態
主な症状は麻痺や運動・知覚機能の消失(完全損傷の場合)や、痙攣・運動機能障害(不完全損傷の場合)があります。
重症度の指標として「ASIA(アメリカ脊髄障害協会)機能障害尺度」があり、最も重度のA(完全麻痺)から正常のEまで分類されています。
ステミラックはASIA機能障害尺度がA、B、Cの患者さんに使用可能です!
その他、脊髄の様々な神経が障害されるため各種の合併症が起こることもあります。
- 呼吸器合併症:呼吸困難など
- 循環器合併症:徐脈や起立性低血圧など
- 消化器合併症:胃潰瘍・十二指腸潰瘍など
- 泌尿器合併症:尿路感染症や敗血症など
脊髄損傷の治療
治療の基本は手術やリハビリテーションが基本です。
手術は物理的に脱臼したり折れたりした箇所を修復することが可能ですが、脊髄の神経が障害を受けている場合、手術では修復不可です。
またリハビリテーションも日常生活の補助となりますが、根治的ではありません。
従って、脊髄の神経の障害を治すような新たな治療が望まれていました。
今回ご紹介するステミラックは「再生医療等製品」に分類されている新規の治療法です。
それではステミラックに関連する「脊髄間葉系幹細胞」について説明します。
脊髄間葉系幹細胞とは
脊髄の中には赤血球や白血球などの「血球成分」と、その元となる「造血幹細胞」がそのほとんどを占めて存在しています。
骨髄間葉系幹細胞とは骨髄中の0.1%に存在している細胞で、主な働きは以下があります。
- 間葉系細胞(骨、血管、脂肪細胞、心筋細胞など)への分化※
- 神経細胞への分化※
※「分化」とは、その細胞へ成長・成熟することを言います。
このように骨髄間葉系幹細胞は様々な細胞に分化する能力を有することから、再生医療として期待されていました。
ステミラック注(骨髄由来間葉系幹細胞)の作用機序・特徴
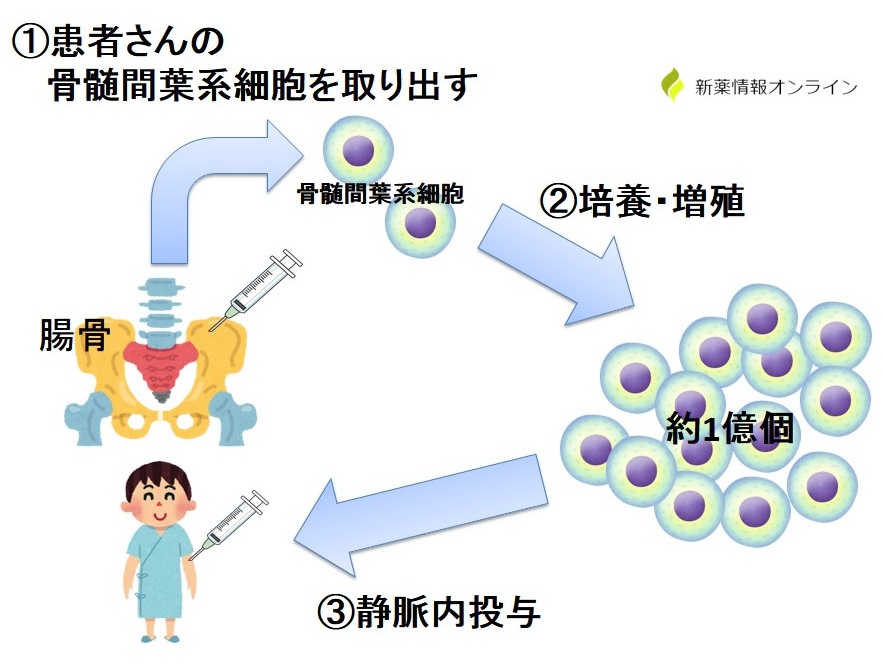
ステミラックは患者さん自身の脊髄から骨髄間葉系幹細胞を採取し、それを培養した後に患者さんの体内に戻すといった再生医療等製品です。
まず、脊髄損傷受傷後31日以内を目安に患者さんの脊髄(腸骨)から局所麻酔下で骨髄液を採取します(下図①)。
これを専門のセンターに送り、骨髄間葉系幹細胞を約2週間で約1万倍にまで培養します(下図②)。
培養により約1億個となった骨髄間葉系幹細胞を30分から1時間かけて静脈内投与により患者さんの体内に投与します(下図③)。
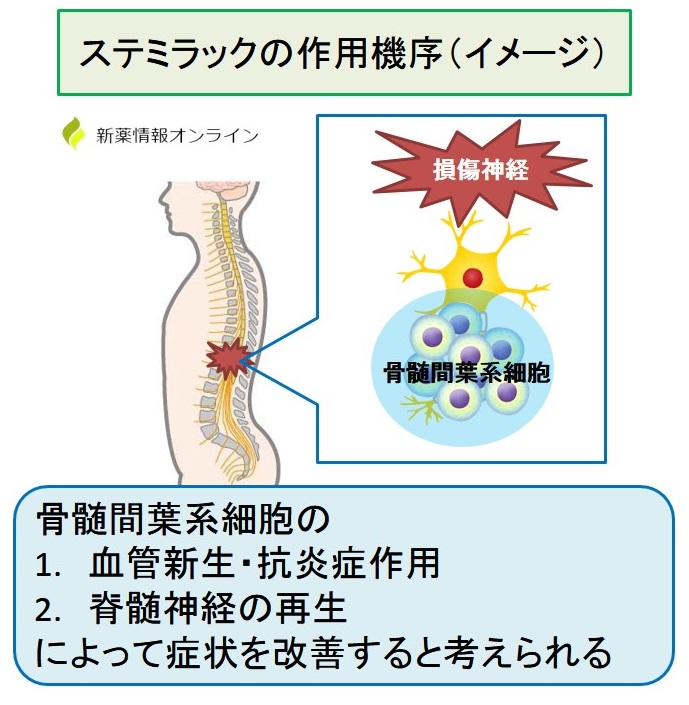
投与された骨髄間葉系幹細胞は
- 損傷した脊髄周囲の血管新生や抗炎症作用
- 脊髄神経の再生
によって神経症候や機能障害の改善効果を示すと考えられています。
このように採取は骨髄(腸骨)からですが、投与する際には静脈に投与できるため、患者さんの負担や侵襲性もあまり大きくはないのが特徴です。
エビデンス紹介
外傷性脊髄損傷で、ASIA機能障害尺度がA・B・Cの患者さんを対象とした国内治験があります。1)
本試験では13例の患者さんのうち12例でASIA機能障害尺度1段階以上の改善が認められています!

条件及び期限付承認と承認条件
今回ステミラックは「再生医療等製品における条件及び期限付き承認制度」によって承認されました。
これは少数例の臨床試験等で
- 有効性がある程度担保される
- 安全性が確認
されれば、条件及び期限を付して早期に承認されるという制度のことですね。
承認条件として以下が設けられていますので、限定承認の7年間のうちにステミラックの有効性・安全性が改めて確認されると思います。
→2025年11月14日に新再生医療等製品として本承認申請が実施されました。
- 緊急時に十分対応できる医療施設において、脊髄損傷の診断・治療に対して十分な知識・経験を持つ医師のもとで、本品の使用が適切と判断される患者に対して、バイタルサインの確認、臨床検査によるモニタリングや管理等の適切な対応がなされる体制下で本品を使用すること。
- 条件及び期限付承認後に改めて行う本品の製造販売承認申請までの期間中は、本品を使用する症例全例を対象として製造販売後承認条件評価を行うこと。
実地臨床でも有効性がしっかりと担保されれば正式承認の流れになるかと思います!
副作用
因果関係が認められた有害事象は以下が報告されています。2)
- 末梢血採取に起因する貧血
- 骨髄液採取に起因する穿刺部位疼痛
薬価
収載時(2019年2月26日)の薬価は以下の通りです。
- ステミラック注 1回分:14,957,755円
参考2019年1月16日の中医協総会1)にて医薬品として収載されることが了承されています
算定方法等については以下の記事をご参照ください。
>>【新薬:薬価収載】13製品+再生医療等製品(2019年2月26日)
まとめ・あとがき
ステミラックはこんな製品
- 脊髄損傷の治療として初の間葉系幹細胞を用いた再生医療等製品
- 患者さん自身の骨髄間葉系幹細胞によって損傷神経の再生を促す
- 条件及び期限付承認(期限は7年間)
ステミラックは2016年に「先駆け審査指定制度」の対象に指定されており、非常に期待されていた治療です。
脊髄損傷では治療選択肢が限られ、合併症の問題もあることから新規の治療が望まれていました。
ステミラックによって患者さんのQOL向上や予後向上に繋がればいいなと感じます♪
ステミラックの最適使用推進ガイドラインも公開されていますので、こちらも併せてご確認くださいませ~。
以上、今回は脊髄損傷とステミラック注の作用機序・特徴についてご紹介しました!
引用資料・文献
- 中央社会保険医療協議会 総会(第405回):「総-2(PDF:351KB)」
- ステミラック 審査報告書:PMDA「再生医療等製品の審査報告書・申請資料概要」
\ 新薬情報オンラインの運営者が執筆! /
薬剤師におススメの記事
失敗しない薬剤師の転職とは?
数多く存在する薬剤師専門の転職エージェントサイト。
どこに登録したらいいのか悩むことも少なくありません。そんな転職をご検討の薬剤師さんに是非見ていただきたい記事を公開しました。
- 新薬情報オンラインの薬剤師2名が実際に利用・取材!
- 各サイトの特徴等を一覧表で分かりやすく掲載!
- 絶対にハズレのない厳選の3サイトを解説!
上手に活用してあなたの希望・条件に沿った【失敗しない転職】を実現していただけると嬉しいです!
-

-
薬剤師の転職サイト3選|評判・求人特徴とエージェントの質を比較
続きを見る
日々の情報収集に最適
-

-
薬剤師の勉強・情報収集に役に立つ無料サイト・ブログ8選



































